守護孩子的第一口呼吸:
兒科醫師給台灣父母的RSV疫苗懶人包
2025年9月15日
潛伏在嬰兒床邊的沉默威脅 - RSV感染遠不僅是普通感冒
呼吸道融合病毒(RSV)過去被視為我們兒科醫師最棘手的敵人之一,它悄無聲息地來襲,卻能對我們最脆弱的嬰幼兒造成毀滅性的打擊。但在2025年的當下,一個重磅的預防好消息來了!
還記得以前在住院醫師時,某次值兒科急診,來了一個剛滿月的健康寶寶;他起初只是幾聲輕微的咳嗽和些許鼻水,家人以為是尋常的感冒。但是短短不到兩天,情況急轉直下。寶寶的呼吸變得又快又深,小小的鼻子每一次吸氣都費力的搧動,肋骨也看到深深凹陷,血氧濃度居然掉到快90%以下。最後,這個原本健康的寶寶被送進了新生兒加護病房,需要靠著住在氧氣帳篷裡才能好好呼吸,一度我們還擔心需要插管上呼吸器才能維持生命。
這個讓無數家庭措手不及的元兇,並不是流感,也不是新冠病毒,而是呼吸道融合病毒(Respiratory Syncytial Virus, RSV)。
在過去,我們只能在嬰兒感染後提供支持性治療,眼睜睜看著他們與病毒搏鬥。但現在我們有了前所未有的武器。我們第一次擁有能夠保護「所有」嬰兒,而不僅僅是少數高危險群體的有效工具。
認識敵人—什麼是呼吸道融合病毒(RSV)?
呼吸道融合病毒特性與攻擊機制:「融合」的致命意義
呼吸道融合病毒(RSV)是一種屬於副黏液病毒科(Paramyxoviridae)的單股RNA病毒。它的名字「融合」(Syncytial)揭示了其獨特且危險的攻擊方式。當RSV病毒感染呼吸道細胞時,它會促使鄰近的細胞膜融合在一起,形成巨大、功能失常的多核細胞團塊,也就是「融合細胞」。
這些壞死的細胞團塊會脫落,混合著黏液,像水泥一樣堵塞嬰兒本就極其微小的呼吸道,這正是RSV對嬰兒尤其致命的主要原因。
RSV的傳播途徑與環境中的存活能力
RSV具有高度傳染性,其傳播方式與許多呼吸道病毒相似,但效率更高。主要途徑包括:
- 飛沫傳染:當感染者咳嗽、打噴嚏或說話時,病毒會透過微細飛沫在空氣中傳播,感染半徑可達2公尺。
- 接觸傳染:RSV能在物體表面存活數小時至數天。在不銹鋼表面可存活超過6小時,在棉織物上則可存活45分鐘。更可怕的是在手上的存活時間,居然可長達1小時。當我們的手接觸到這些被污染的物體後,若再觸摸眼、口、鼻,病毒便能輕易入侵。
這種強大的環境存活能力,解釋了為何RSV能在產後護理之家(月子中心)、托嬰中心等嬰幼兒群聚場所迅速引爆群聚感染。一個不經意的觸摸,就可能將病毒帶給免疫系統尚未成熟的寶寶。
家庭中隱形的威脅鏈
在臨床上,最常見的嬰兒RSV感染悲劇,往往源於家庭內部。成人或年齡較大的兒童感染RSV後,症狀通常與普通感冒無異,可能只是輕微的鼻塞、流鼻水和咳嗽。然而,他們在症狀輕微的3至8天內,卻是病毒的強力傳播者。
相比之下,免疫系統不成熟的嬰幼兒感染後,排毒期可能長達3至4週。這種不對稱的威脅模式,使得家長往往在不知不覺中成為孩子感染的源頭。
這形成了一條危險的傳播鏈:
家中的哥哥姐姐或爸爸媽媽,從學校或公司帶回病毒,出現了他們自認為「不礙事」的輕微感冒症狀。他們沒有與家中的新生兒嚴格隔離,出於關愛,正常的抱抱、餵奶、更換尿布等行為仍在繼續。對於成人來說只是小麻煩的病毒,一旦進入新生兒體內,就會因為其狹窄的氣管和脆弱的免疫系統,演變成一場危及生命的重症。
更令人擔心的事情是,被感染的嬰兒會變成一個「超級傳播者」,在長達一個月的時間裡持續向外排出大量病毒,對家中其他成員,特別是共同照顧的長輩,構成新的威脅。
所以我們要建立一個觀念:對寶寶最大的威脅,往往來自於那些帶著「小感冒」卻不設防的家人們。雖然勤洗手、戴口罩等防護措施有幫助,但這種很難避免的家庭內部接觸讓預防感染傳播充滿挑戰,因此凸顯了建立主動免疫防護的必要性。
台灣的RSV氣候—一場全年無休的挑戰
台灣獨特的RSV流行模式與季節分布
許多認真的家長可能有查到國外的資料得知,RSV是一種「冬季病毒」。
雖然在美國、歐洲等溫帶地區,RSV的流行的確是集中在秋冬季節,但台灣地處亞熱帶,溫暖潮濕的氣候為病毒提供了全年皆可生存和傳播的溫床。
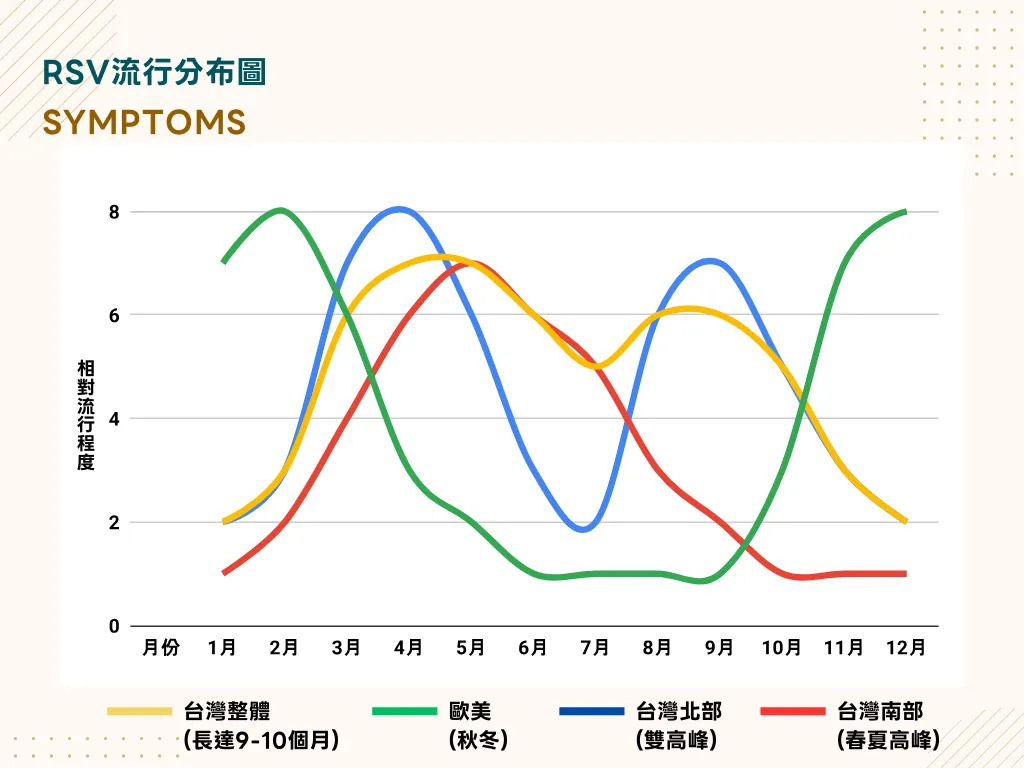
根據台灣本土的監測數據,RSV的流行呈現出與歐美截然不同的模式:
- 台灣北部:呈現明顯的「雙高峰」分佈,第一波高峰出現在春季(約3月至5月),第二波則落在夏末秋初(約8月至10月)。
- 台灣南部:流行高峰則主要集中在春夏季節(約4月至7月)。
- 台灣整體:RSV流行季長達9-10個月,遠超過歐美國家的5個月流行期。
COVID-19後的RSV流行規律變化
自COVID-19疫情後,全球呼吸道病毒的流行規律被打亂。台灣也觀察到RSV的流行季節出現延後且集中的趨勢。
研究顯示,與2018-2019年相比,台灣北部的RSV季節性高峰在2020年延後2個月,2021年幾乎消失,2022年和2023年分別延後3個月和2個月。這顯示了病毒的不可預測性,也再次證明了全年保持警惕的重要性。
誰是RSV最高風險的受害者?破除「健康寶寶神話」
6個月以下的嬰兒是風險最高的族群。傳統上,我們認為的高風險族群包括:
- 早產兒(特別是懷孕週數小於35週者)
- 患有先天性心臟病或慢性肺病的嬰幼兒
- 免疫系統低下(如接受化療)的孩童
然而,一個在臨床上不斷被證實、卻常被大眾忽略的殘酷事實是:絕大多數(超過70-80%)因RSV重症住院的嬰兒,是出生時健康且足月的寶寶。
這個數據徹底顛覆了許多家長的認知。他們可能認為自己健康的足月寶寶身體強壯,不會輕易生重病。但對於RSV而言,所有嬰兒的生理結構都是先天的弱點——他們窄如筆芯的支氣管,一旦發炎腫脹就極易導致呼吸困難。
在台灣,每年約有1,000-2,300名嬰幼兒因感染RSV而住院,其中高達90%為兩歲以下的嬰幼兒。更令人擔憂的是,從2009年至2020年間,台灣0-1歲嬰兒因RSV相關病症的住院率從0.95%上升至1.71%,顯示問題日益嚴重。
因此想將歐美地區以「RSV旺季」為導向的預防策略套用在台灣是不適用的。你想想看,如果一個在台灣2月份出生的寶寶,他最脆弱的時期-0到6個月大概將落在2月至8月。如果我們等到秋冬的「傳統旺季」才開始提醒預防,這個寶寶早已錯過了保護的黃金窗口,暴露在春夏季的高風險之中。
這正是為何在台灣,任何有效的RSV預防措施,無論是孕婦疫苗還是嬰兒單株抗體,都必須是全年皆可提供施打。我們不能再等待「季節」的來臨,因為在台灣,RSV的威脅從不休假。
辨識紅色警報—跨年齡層的RSV症狀表現
RSV感染的狡猾之處在於其症狀的「變臉」能力。同一個病毒,在不同年齡和健康狀況的人身上,會呈現出截然不同的樣貌。
RSV在嬰兒的症狀— 一場欺騙性的病程演進
嬰兒感染RSV的病程往往是漸進式的,初期症狀極具迷惑性,很容易被當作普通的小毛病而延誤就醫。
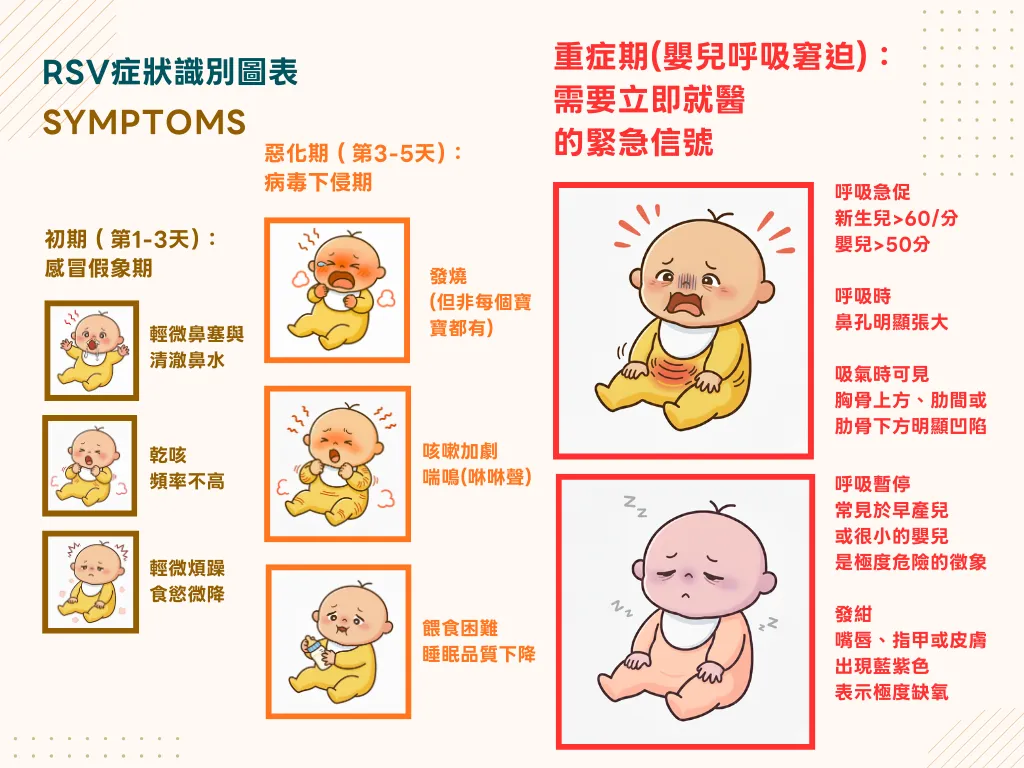
初期(第1-3天):感冒假象期
輕微鼻塞與清澈鼻水:症狀與一般感冒完全相同
偶發性咳嗽:乾咳,頻率不高
輕度食慾下降:可能稍微減少奶量
輕微煩躁:但仍可安撫
這個階段最容易讓家長掉以輕心,認為只是普通的小感冒。
惡化期(第3-5天):病毒下侵期
咳嗽加劇:從偶發變為持續性咳嗽,且可能帶痰
喘鳴聲(Wheezing):這是RSV感染的特徵性症狀,呼吸時會聽到類似「吹口哨」的高頻音
發燒:體溫可能升至38度以上,但也有相當比例的嬰兒不發燒
餵食困難:因呼吸不順暢,導致吃奶時頻繁中斷或拒絕進食
睡眠品質下降:因呼吸不適而睡不安穩
重症期:需要立即就醫的緊急信號
以下任何一個症狀出現,都需要立即送醫:
- 呼吸急促(Tachypnea):新生兒呼吸次數超過每分鐘60次,2-12個月嬰兒超過每分鐘50次
- 鼻翼搧動(Nasal Flaring):每次呼吸時鼻孔明顯張大,這是身體試圖增加氣流的表現
- 胸壁凹陷(Retractions):吸氣時可見胸骨上方、肋間或肋骨下方明顯凹陷
- 呼吸暫停(Apnea):特別常見於早產兒或很小的嬰兒,是極度危險的徵象
- 發紺(Cyanosis):嘴唇、指甲或皮膚出現藍紫色,表示嚴重缺氧
呼吸道融合病毒大人症狀— 不知情的傳播者
健康成人感染RSV時,症狀通常輕微且與普通感冒難以區分:
- 鼻塞、流鼻水
- 輕微咳嗽
- 低度發燒或不發燒
- 輕度喉嚨痛
高風險成人(60歲以上、慢性病患者)則可能出現較嚴重症狀:
- 持續性咳嗽伴隨濃痰
- 呼吸困難或喘促
- 發燒超過38.5度
- 慢性病惡化(如氣喘、COPD)
對於高風險的成人而言,RSV絕非小病。它可能引發急性細支氣管炎、肺炎,或是慢性病急性惡化,導致需要住院治療,甚至有生命危險。值得一提的是,知名藝人張學友曾因感染RSV而取消演唱會,這讓大眾意識到就算是成人,也千萬不能小看這個病毒的殺傷力。
關鍵的十字路口—感染呼吸道融合病毒要住院嗎
決定感染RSV是否住院的關鍵因素與醫療評估
當家長焦急地問「我的寶寶需要住院嗎?」,兒科醫師的判斷標準並非病毒本身,而是寶寶的身體是否還能應付病毒帶來的挑戰。目前,醫學界尚無專門殺死RSV的特效抗病毒藥物。因此,住院治療的本質是「支持性療法」,也就是在寶寶自身的免疫系統戰勝病毒之前,利用醫療設備幫助他度過最危險的階段。
決定是否需要住院的關鍵因素包括:
- 缺氧(Hypoxia):當寶寶因呼吸道阻塞而無法吸入足夠氧氣,導致血氧飽和度下降時,就需要住院給予穩定的氧氣支持。
- 脫水(Dehydration):寶寶呼吸過於費力,會導致他無法協調「吸吮、吞嚥、呼吸」這一連串複雜動作,進而影響喝奶。當進食量嚴重不足,出現尿量減少等脫水跡象時,就需要住院透過靜脈輸液來補充水分和電解質。
- 呼吸衰竭風險:如果寶寶的呼吸窘迫持續加劇,出現前述的胸凹、鼻搧等症狀,代表他即將筋疲力盡。為了避免呼吸衰竭,需要及時住院密切監測,甚至可能需要使用呼吸器輔助呼吸。
- 年齡因素:6個月以下嬰兒,特別是3個月以下,特別容易因為症狀嚴重導致需要住院。
令人警惕的台灣RSV相關統計數據
在台灣,RSV對醫療系統造成的負擔極為沉重:
- 每年有1,000-2,300名嬰幼兒因感染RSV而住院
- 高達90%為兩歲以下的幼童
- RSV是造成一歲以下嬰兒細支氣管炎和肺炎住院的首要原因
- 在所有因RSV住院的6個月以下嬰兒中,高達28.7%的寶寶病情嚴重,需要轉入兒童加護病房(PICU)
- 早產兒出生3個月內感染RSV,入住加護病房的比例高達72%
更令人震驚的是,台灣研究顯示,一名兒童因感染RSV而住院的醫療費用可能高達20萬台幣,平均住院3至7天,嚴重者更高達20幾天。
面對RSV,每一個新生兒,都是高風險的新生兒
在討論住院風險時,身為一個兒科醫師,我需要特別破除大家一個錯誤的觀念-「我的寶寶是足月出生的健康寶寶,所以風險很低」。
大量的臨床數據和研究一致指向一個事實:超過70%至80%因RSV重症住院的嬰兒,是先前完全健康、且足月出生的寶寶。
為什麼會這樣?因為對於RSV來說,最大的危險不是來自寶寶出生時是否「健康」,而是他生理結構上的「脆弱」。所有新生兒的呼吸道都同樣狹窄,他們的免疫系統都同樣不成熟。從前大多強調早產兒的風險,這讓足月寶寶的家長低估了初期症狀的嚴重性,或在預防措施上有所鬆懈。
所以各位家長們要更清楚的是:面對RSV,每一個新生兒,都是高風險的新生兒。只有所有家長都理解到,自己的心肝寶貝無論出生時多麼健康,都處於RSV的重症威脅之下時,才能真正理解到預防(如孕婦接種疫苗或嬰兒施打單株抗體)的急迫性與必要性。
長遠的影響—呼吸道融合病毒留下的呼吸道後遺症
RSV對嬰兒的傷害,遠不止於住院期間的痛苦。越來越多的醫學證據表明,一次嚴重的嬰兒期RSV感染,可能像一道長長的陰影,影響孩子未來數年甚至數十年的呼吸道健康。這就是所謂的「長RSV」(Long RSV)後遺症。
RSV感染與氣喘的密切關聯:
國際研究顯示,一歲內感染RSV(特別是嚴重到需要住院)的寶寶,其日後出現反覆性喘鳴及被診斷為氣喘的風險顯著高於未感染過的同年齡孩子。
背後的生理機制,醫學界推測是嬰兒期那場劇烈的RSV感染,對正在發育的、脆弱的呼吸道造成了結構性的改變或損傷(稱為「氣道重塑」),同時也可能干擾了免疫系統的正常發育,使其變得過度敏感。這就導致孩子的呼吸道在未來遇到過敏原、其他病毒或環境刺激時,更容易產生劇烈的發炎反應,從而誘發氣喘。
重新評估RSV疫苗的真實成本效益
從長期健康經濟學角度來看:
不預防的潜在成本:
- 急性期成本:一旦寶寶不幸感染RSV並發展為重症,住院的醫療費用可能高達20萬台幣。這還不包括父母為了照顧孩子而請假所損失的薪資,以及全家人身心承受的巨大壓力。
- 長期成本:如果孩子因此留下了氣喘的後遺症,這意味著未來長達十年的慢性病管理。這包括了頻繁的門診費用、吸入型藥物的費用、因氣喘急性發作而跑急診的費用,以及孩子因運動受限、夜間咳嗽等對生活品質造成的無形影響。
預防的成本:
- 一筆一次性的、可預期的費用。長期來看,預防策略通常具有良好的成本效益。
與其讓寶寶或是長輩因為感染而可能住到加護病房裡,不如在能夠預防的時間點就好好做好防護。兩千年前黃帝內經就說過:「上醫治未病之病,謂之養生;中醫治欲病之病,謂之保健;下醫治已病之病,謂之醫療。」我們應該要在寶寶或長輩還健健康康的時候就幫他們搭建好防護罩,而非真的感染了才急急忙忙地去治療。
為寶寶打造針對呼吸道融合病毒的免疫防護罩
被動免疫—RSV單株抗體防護罩
被動免疫的概念,就像是直接為寶寶聘請一批訓練有素的保鑣。我們不要求寶寶自己不成熟的免疫系統去辛苦地製造抗體,而是直接將實驗室精準製造的、專門對抗RSV的抗體注射到寶寶體內,提供立即、高效的保護。
傳統武器:Palivizumab (藥品名: Synagis® 西那吉斯)
這是一種較早問世的「人源化」單株抗體,多年來一直是預防高風險嬰兒感染RSV的標準療法。其局限性相當明顯:保護力較短,需要每個月注射一次,在整個流行季節可能需要打上5至6劑;其預防住院的有效性約在50-55%之間;且因價格高昂,健保僅給付給極少數特定高風險族群(如極度早產兒、患有嚴重先天心肺疾病者)。
- 給付方式:每月施打一次,連續5個月,能降低約35%-45%因RSV感染住院的機率。
- 健保擴大給付:2025年6月起,健保進一步擴大給付範圍至滿33週至未滿36週的早產兒,可獲健保給付最多3劑。
革命性新武器:Nirsevimab (藥品名: Beyfortus® 貝福妥)
2024年9月,台灣衛生福利部食品藥物管理署核准Nirsevimab預防RSV引起的下呼吸道疾病,這是一個劃時代的突破:
關鍵優勢:
一針提供長效保護:透過基因工程技術延長了抗體在體內的半衰期,使得單次注射就能提供長達5至6個月的保護力,完美覆蓋了嬰兒最脆弱的整個時期。超高保護效率:Nirsevimab會針對病毒F蛋白上一個更關鍵、更穩定的位點,其中和病毒的能力遠超Palivizumab。大型臨床試驗證實,它能將RSV相關的住院風險降低超過83%,重症住院保護力更高達90%。適用於所有嬰兒:其設計理念是「普遍預防」,目標是保護所有未滿一歲的嬰兒,而不僅僅是傳統定義的高風險群體。
主動免疫—家長給寶寶的最佳保護
主動免疫則立用了一個更巧妙的人體機制:借力使力。我們透過為準媽媽接種疫苗,激發母體產生大量、高效的抗RSV抗體。這些抗體會經由胎盤,主動輸送到胎兒體內。這意味著,寶寶在出生的那一刻,體內就已經裝備了來自媽媽的、足以對抗RSV的強大抗體軍隊。
母嬰保護疫苗:Abrysvo® (艾沛兒)
2025年5月,孕婦RSV疫苗終於在台灣可以施打!這是專為孕婦設計的RSV疫苗:
- 最佳接種時機:建議在懷孕第28週至36週之間接種單一劑量。這個時間窗口的選擇經過精密計算,旨在確保母體有足夠時間產生抗體,並在分娩前將抗體濃度最大化地傳遞給胎兒。
- 經實證的保護力:臨床試驗數據顯示,孕婦接種Abrysvo®後,能有效將新生兒出生後6個月內因RSV引起的重症下呼吸道疾病風險降低超過81%。
60歲以上成人疫苗:Arexvy®(欣剋融)
台灣衛生福利部於2024年1月30日核准Arexvy用於60歲以上的長輩們,這不僅能保護他們自身免於RSV重症威脅,也能從源頭上減少病毒在家中傳播給嬰幼兒的機會,形成一道「防火牆」。值得注意的是,疫苗保護力竟然長達3年,在寶寶剛出生、最手忙腳亂的時期,不會因為寶寶或是長輩因為RSV住院而更火上澆油。
父母與醫師的「二選一」新課題
這兩種革命性工具的出現,為準父母和兒科醫師帶來了一個全新的、幸福卻也重要的抉擇:要麼在懷孕期間讓媽媽接種疫苗,要麼在寶寶出生後為其注射長效單株抗體。
一位懷孕30週的準媽媽,可以選擇立刻接種Abrysvo®疫苗。只要她在分娩前至少兩週完成接種,寶寶出生時就能獲得保護,這種情況下,寶寶通常就不再需要出生後注射Nirsevimab。
如果準媽媽因為各種原因錯過了接種疫苗的窗口,或者選擇不接種,那麼保護寶寶的主要方式就變成了在出生後儘快為其注射Nirsevimab。
這意味著,關於RSV預防的討論,必須從兒科診間提前到婦產科診間。婦產科醫師、兒科醫師和準爸媽們需要好好溝通,共同根據懷孕週數、經濟狀況、個人意願等因素,提前做出最適合的、主動的預防決策,而不是等到寶寶出生後再來被動應對。
現實面的考量—台灣目前呼吸道融合病毒疫苗費用與補助現況
雖然這些預防工具在醫學上是巨大的進步,但在台灣,它們目前對大多數家庭而言仍是一筆可觀的自費開銷。了解清楚費用與補助的現況,可以幫助爸媽們做出最適當的選擇。
RSV補助政策懶人包
中央健康保險署(健保)給付範圍
目前健保的給付範圍僅限於舊型的、短效的單株抗體Palivizumab (Synagis®),且給付對象極為嚴格,僅包含部分早產兒、患有特定嚴重先天性心臟病或慢性肺病的嬰兒。醫學界正在積極爭取擴大給付範圍,雖然從2025年6月起擴大至滿33週至未滿36週的早產兒,但截至目前,新型的孕婦疫苗(Abrysvo®)和長效嬰兒單株抗體(Nirsevimab®)皆未納入健保給付。
地方政府補助情況
截至目前,台灣還沒有地方政府有提供RSV疫苗或單株抗體的補助,因此家長應有此為全額自費項目的心理準備。但是隨著醫界持續呼籲,部分縣市政府正在評估相關補助政策的可行性。
台灣RSV預防選項與自費價格參考表
為了讓大家能一目了然地比較各種選項,我整理了一份預防策略與自費費用對照表,大家在和自己的醫師討論時可以當作參考。
| 預防方式 | 目標對象 | 免疫機制 | 施打劑程 | 預估自費價格 (新台幣) | 健保補助 |
|---|---|---|---|---|---|
| 成人疫苗 Arexvy® (欣剋融) | 60歲以上成人 50-59歲高風險成人 | 主動免疫 (基因重組疫苗) | 1劑 | 約 $7,000 - $8,000 元 | 無 |
| 孕婦疫苗 Abrysvo® (艾沛兒) | 懷孕28-36週孕婦 | 主動免疫 (母傳抗體) | 1劑 | 約 $7,000 - $8,000 元 | 無 |
| 長效單株抗體 Nirsevimab (Beyfortus®) | 所有未滿1歲嬰兒 | 被動免疫 (直接給予抗體) | 1劑 | 約 $16,000 - $17,500 元 | 無 |
| 短效單株抗體 Palivizumab (Synagis®) | 特定高風險嬰兒 | 被動免疫 (直接給予抗體) | 每月1劑 (最多6劑) | 約$10000-12000 元 / 劑 | 有 (僅限特定條件) |
守護下一代,施打RSV疫苗刻不容緩
看完這篇文章,想必你也清楚理解RSV對於寶寶來說,是一個相當大的潛在威脅,隨時就潛伏在身邊。身為一名兒科醫師,我認為每一個嬰兒都值得獲得最好的保護。世界衛生組織(WHO)已建議各國採取嬰兒RSV免疫接種策略,目前已有29個地區推行全嬰兒接種。
所有嬰兒都是高風險族群,那種認為只有早產兒或體弱寶寶才需要擔心的觀念是已經過時且錯誤的。絕大多數因RSV重症住院的,都是健康的足月寶寶。
我的建議是:
- 高風險嬰兒(早產兒、先天性疾病):優先考慮健保給付的單株抗體 Palivizumab (Synagis®)
- 一般孕婦:在經濟許可下,建議於28-36週接種孕婦RSV疫苗 Abrysvo® (艾沛兒)
- 一般嬰兒:如家庭經濟允許,可考慮出生後接種長效單株抗體 Nirsevimab (Beyfortus®)
- 60歲以上長者:特別是有慢性病或家中有嬰幼兒者,建議接種成人RSV疫苗 Arexvy® (欣剋融)
但無論選擇哪種預防策略,都要提早規劃。台灣的RSV全年流行,不像歐美有明確的季節性,這意味著我們需要更積極的預防措施。
與其讓寶寶因為感染而住進加護病房,承受插管、呼吸器的痛苦,不如在他們還健康的時候就為他們建立起堅固的免疫防護罩,給他們一個健康無憂的童年,和一個不受RSV陰霾籠罩的未來。
文獻來源參考
點此展開/收合詳細文獻列表
台灣本土指引與資料
台灣兒童感染症醫學會-守護兒童健康:RSV防治之現況與展望
兒童感染症醫學會 - 呼吸道細胞融合病毒感染免疫預防建議
台灣周產期醫學會. 呼吸道融合病毒(RSV)母嬰預防共識指引 . 2025
國際期刊與研究
Hsieh YH, Lee WI, Chang LY, et al. Burden of respiratory syncytial virus in older adults in Taiwan. Clin Infect Dis. 2024 Aug 7;78(3):e123–9.
U.S. Food and Drug Administration. FDA grants approval to the RSV vaccine (nirsevimab-alip) for infant immunization. 2023 Sep 1.
Hall CB, Weinberg GA, Iwane MK, et al. Seasonality and risk factor analysis of respiratory syncytial virus infection over ten years. PLOS One. 2023 Oct 26;18(10):e0292829.
Velázquez FR, Blyth CC, Yeoh DK, et al. Prolonged seasonality of respiratory syncytial virus infection: A 2‐year longitudinal study in subtropical Taiwan. PLOS One. 2014 Oct 20;9(10):e1110166.
Cui G, Zhu X, Yang Z, et al. Seasonal peaks and risk factors of respiratory syncytial virus infection in rural Taiwanese children: A ten-year retrospective study. PLOS One. 2018 May 9;13(5):e0197410.
Ponce LJ, Wu T, Sim DJ, Chow JY, Wee LE, Chia PY, Lye DCB, Leo YS, Lim JT. Respiratory syncytial virus hospitalization costs, rates, and seasonality in Asia: a systematic review and meta-analysis. EClinicalMedicine. 2025 Jul 10;86:103350.
Falsey AR, Hennessey PA, Formica MA, Cox C, Walsh EE. Respiratory syncytial virus, recurrent wheeze and asthma. J Allergy Clin Immunol. 2022 Sep 7;150(3):896–903.e2.
